小儿急性髓样白血病(4)
AML1也是形成发育完整的造血系统所必需的,AML1基因剔除的纯合子小鼠由于缺乏胎肝和脑出血而死于胚胎期,AML1还可通过激活并刺激细胞周期素 D2表达,缩短细胞周期G1期,加速进入S期,从而促进造血干/祖细胞的成熟与分化。ETO编码一个与哺乳动物同源的果蝇Nervy蛋白。ETO蛋白能直接与核受体辅助抑制因子N-CoR及Sin3A相互作用并招募一个活跃的组蛋白去乙酰化酶(HDAC,histone deacetylase),形成一个核辅助抑制复合物。在该复合物中,ETO蛋白行使连接蛋白的功能。融合基因产物包含AML1 DNA结合域,而激活域则被ETO取代。AML1-ETO结合至AML1靶序列后,通过AML1-ETO/NcoR/Sin3A/HDAC复合物抑制 AML1介导的转录激活,呈现显性负调节作用。同时AML1/ETO还获得新的功能,能够激活抗凋亡基因BC12的表达,抑制细胞的凋亡。
除经典易位外,一些累及8q22及21q22的变异型易位也已被发现。简单变异易位如累及21q22的伙伴染色体有 2q21,3p14,5q13,13q14,17q22。累及22q22的伙伴染色体有 3q22,11q13,16q24,20p13,22q13,19q13等。同时累及8,21以及其他染色体异常,称为复合变异易位,至今已发现28余种,临床上尚无区别于典型t(8;21)的特征性表现。
B.t(15;17)(q22;q21)与PML-RARA:由Rowley 1977年首次鉴定,可见于70%的APL患者,分子检测显示100%APL具有t(15;17),由于它从未见于其他白细胞亚型和肿瘤,因此成为APL高度特异性细胞遗传学标志。
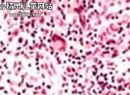
a.临床特征:临床上有多颗粒型和细颗粒型两种类型,以多颗粒型常见,约占80%的病例,表现为颗粒粗大,遮蔽于核上。20%的APL为细颗粒型,光镜难以鉴别,通过电镜及细胞化学染色可确定。
年轻患者,就诊时常有DIC表现,外周血常有三系减少,骨髓以异常早幼粒细胞为主,髓系过氧化物酶强阳性,免疫表型特征:可表达CD13,CD33;HLA-DR,CD2可在细颗粒APL中有表达。本组患者总的疗效好,生存期长。
b.基因特征:位于15q21上的RARα基因与位于17q21上的PML基因发生融合,形成两个融合转录本,即PML/RARα和RARα/PML。 PML/RARα可见于100%APL患者中,而PML/RARα只有70%的病例可检测到。依据PML基因断裂点的不同可产生3种不同形式的融合转录本。
部分资料表明,短型与儿童APL有关,表现为高白细胞、细颗粒,预后差。具有长型或短型APL患者维A酸治疗有效;而具有变异型对维A酸敏感性差。
t(15;17)
部分资料表明,短型与儿童APL有关,表现为高白细胞、细颗粒,预后差。具有长型或短型APL患者维A酸治疗有效;而具有变异型对维A酸敏感性差。
t(15;17)变异易位包括简单变异易位和复杂变异易位,简单变异易位通常只累及RARα基因。下列3种已明确分子特征的易位。
PML具有肿瘤抑制功能,RARA具有分化启动与生长抑制活性,是正常造血所必需的。RARA转录调节作用是通过与视黄醛受体(retinoid X recepor,RXR)结合形成异二聚体,然后结合至许多基因启动子中的维A酸反应元件(Retinoic acid response elements,RAREs)而调控这些基因的表达。当RARA不与配体结合时,则与N-CoR/mSin3A/HDAC结合形成核辅助抑制复合物,呈现转录抑制。当RARA与配体结合后,则脱离核辅助抑制复合物,转而与具有乙酰基转移酶作用的大分子结合,使组蛋白乙酰化,导致染色质结构改变,转录激活。
PML/RARA可与PML或其他维A酸结合蛋白结合,以显性负性作用方式抑制野型PML及RARA的功能。PML/RARA与 PML结合使PML脱离正常生理定位,失去抑制细胞生长的功能。PML/RARA与RAREs结合,可竞争性抑制RARA与RAREs的结合,不能启动靶基因的转录;PML/RARA与N-CoR/mSin3A/HDAC转录抑制复合物高亲和力结合,生理水平的全反式维A酸(all- transretinoic acid,ATRA)难以使其解离,使靶基因处于转录关闭状态,髓系分化阻滞。ATRA的治疗原理在于一方面可使PML/RARA降解;另一方面使PML /RARA脱离转录抑制复合物,并启动靶基因的转录,诱导细胞分化。
复杂变异易位至今已发现23种之多,尽管累及除15,17以外的一个或多个染色体,但分子检测都能发现PML/RARα融合基因。且这些病例皆能获得与典型易位相似的维A酸治疗疗效,从而表明,维A酸的疗效与PML/RARα融合转录本密切相关。
C.16q异常与CBFB:1983年Arthur和Bloomfild首次描述5例AML患者(AML-M2 3例,AML-M4 2例)骨髓中伴有过量的嗜酸细胞,且这5例患者染色体核型皆有16q-。Le Bea报道18例AML-M4患者伴有嗜酸细胞增高,15例为inv(16)(p13q22),3例为t(16;16)(p13;q22)。这种嗜酸细胞异常与特征性染色体改变的关系在第4届国际白血病染色体专题讨论会上被确定。最近的WHO髓系恶性肿瘤的分类系统中将伴有16q22异常的AML患者作为独立的亚型存在。它有3种类型,按出现频率依次为:inv(16)(p13q22);del(16)(q22);t(16;16)(p13;q22),三者具有相同的断裂位点和临床特征。