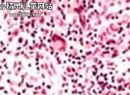
小儿遗传性球形红细胞增多症(3)
(3)脾脏对红细胞的调节与破坏:HS红细胞由于表面区域缺失和细胞密度的增加,一旦经脾脏扣留将经受附加的损伤,在脾切除时有红细胞移出脾脏就是证据。这些经脾脏处理过的红细胞重返血液循环,可以通过渗透脆性检测出这部分细胞群。脾切除后,这些红细胞群消失。早期通过模拟脾脏条件(包括低pH值、隔离的红细胞可以与网状内皮系统接触等)进行HS红细胞的体外培养研究显示,糖缺失和接踵而来的细胞内ATP的缺乏并非HS 红细胞在脾脏破坏的原因。脾脏条件的影响显示出的是累积的损伤。HS红细胞在脾索停留的时间平均为10~100min,只有1%~10%流经脾脏的血液是暂时滞留于脾脏并充满脾索,其余的90%血液迅速流入静脉循环。虽然HS红细胞主要在脾脏扣留和破坏,但HS细胞也在其他外周的器官被破坏。
HS红细胞表面改变触发网状内皮系统吞噬作用的机制尚不清楚。一个途径可能是脂质双分子层结构内磷脂的破坏,导致磷脂酰丝氨酸外侧暴露,促进红细胞附着于网状内皮系统,使其在脾脏以外的其他器官被吞噬破坏。虽然磷脂在两个脂质双层内的分布在绝大多数HS患者是正常的,但在一些严重的HS患者有磷脂分布的异常改变。还有一种猜测,经脾脏处理过的末期HS红细胞具有磷脂不均匀的发生。
2.分子机制
正常红细胞的膜是有非酯化胆固醇和糖脂插入的不对称性磷脂双层结构。膜的外层为胆碱磷脂(磷脂酰胆碱也称卵磷脂和鞘磷脂),内层为氨基酸磷脂(磷脂酰氨基乙醇和磷脂酰丝氨酸)。红细胞膜也含有不对称的蛋白成分。所有的糖蛋白暴露于膜的外侧表面,具有红细胞抗原和受体或转运蛋白。这个整体的膜蛋白穿透或跨越脂质双层,与疏水脂质的核心部位相互作用并且紧紧地束缚红细胞膜。
一个独立的蛋白网络与整体膜蛋白和脂质双层形成垂直和水平相互作用的膜骨架。膜骨架包括血影蛋白(或称收缩蛋白,又分为α和β spectrin)、锚蛋白(ankyrin)、蛋白4.1、蛋白4.2和肌动蛋白。HS被分为以下5种亚型:单一血影蛋白部分缺乏、血影蛋白与锚蛋白连接部分缺乏、带3部分缺乏、蛋白4.2缺乏和其他少见的共同缺乏。